|
|
|
proteine
Proteinele sunt produşi naturali macromoleculari, care prin hidroliză formează α -aminoacizi. Ele sunt componente esenţiale ale materialelor lichide şi gelificate din celule. Sunt proteine: enzimele, biocatalizatorii, pigmenţii respiratori, mulţi hormoni şi anticorpi.
Proteinele se caracterizează prin specificitatea lor. Uneori se observă deosebiri chiar între proteinele indivizilor aceleaşi specii. Faptul acesta se datorează succesiunii aminoacizilor într-o macromoleculă proteică.
Cei 20 de aminoacizi esenţiali se pot permuta conform formulei: nr. de posibilităţi (N) N=20! adică 2.432.902.000.000.000.000
O clasificare a proteinelor se face după solubilitatea în apă.
Există proteine insolubile în apă: keratina (din păr, unghii, epidermă), colagenul (din piele,oase şi tendoane) şi fibroina din mătase.
Proteinele solubile în apă sunt albuminele. Proteinele solubile în electroliţi sunt globulinele (din serul saguin, enzime, hormoni, anticorpi, toxine).
Proteinele insolubile se separă uşor, dar nu pot fi purificate în întregime. Proteinele solubile suferă uşor, la încălzire sau sub acţiunea acizilor, bazelor sau solvenţilor, o transformare numită denaturare, prin care se pierde activitatea biologică.
Proteinele se extrag cu o soluţie salină, mai rar cu solvenţi organici (glicerină sau acetonă). Separarea acesteia de substanţele neproteice se face prin dializă şi electrodializă.
Există membrane permeabile pentru substanţele neproteice şi care le reţin pe cele proteice. O mare importanţă pentru analiza unui amestec de proteine, o are metoda numită electroforeză. Proteinele, în funcţie de masa lor moleculară, migrează spre anod în soluţie bazică şi spre catod în soluţie acidă. În acest fel au fost separate proteinele din sânge: albuminele şi globulinele (α,β şi γ). O stare de sănătate bună este dată de un raport supraunitar dintre albumine şi globuline.
Proteidele (proteinele conjugate) sunt combinaţii dintre o enzim (proteină) şi o moleculă neproteică, numită grupă prostetică. Astfel, hemoglobulinele sunt cromoproteide din sânge, având drept grupă prostetică protoporfirina.
Cercetările proteinelor cristalizate cu raze X, au contribuit foarte mult la cunoaşterea structurii lor polipeptidice (Pauling şi Corey). Se disting 4 grade structurale, deosebindu-se prin complexitatea lor:
|
1) Structuri primare; 2) Structuri secundare; 3) Structuri terţiare; 4) Structuri cuaternare. |
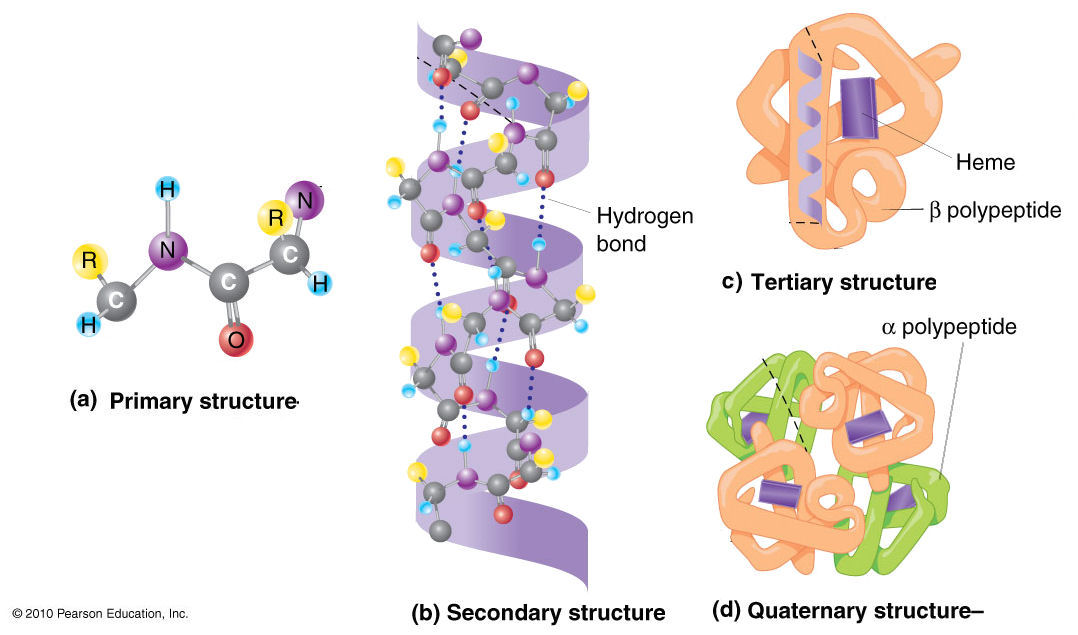 |
1. Structurile primare ale unei proteine sunt determinate de numărul şi sucesiunea specifică α-aminoacizilor din catena polipeptidică. Lucrul acesta se realizează prin hidroliza lanţului polipeptidic, prin determinări de mase moleculare şi prin utilizarea unei tehnici complexe: cromatografie asociată unei analize spectrometrice de masă. Prin atomul de hidrogen legat de atomul de azot se formează legături de hidrogen intramoleculare, care determină structurile secundare.
2. Structura secundară este determinată de adevărata aşezare în spaţiu a atomilor ce alcătuiesc proteina. Cercetările au sugerat o macromoleculă polipeptidică în formă de spirală (elicea lui Pauling). Conformaţia elicei α se întâlneşte într-un număr foarte mare de proteine şi este implicată în construcţiile terţiare şi cuaternare.
3. Structura terţiară este determinată de legăturile ce se pot stabili spre exterior între două elice α. Aceste legături pot fi: van der Waals, legături de hidrogen, legături electrovalente şi covalente (punţile de sulf).
4. Mai multe asemenea structuri terţiare asociate între ele, formează agregate mai complicate, aşa numitele structuri cuaternare, care se denaturează primele.

|
- Home
- Chimie-bl.eu
- Moodle chimie
- Substante anorganice
- Lectii AEL chimie
Legaturi utile
